ØÔ╦ßî┘©»╬gÔg╗»¼F(xi¿ñn)¤¾
2019-4-13 11:54:23 ³cô¶ú║
─│ð®╗¯Øè¢î┘╗‗ãõ║¤¢▒Ý├µÈ┌─│ð®¢Ú┘|(zh¿¼)¡h(hu¿ón)¥│¤┬ò■░l(f¿í)╔·Ê╗ÀNÛûÿOÀ┤æ¬(y¿®ng)╩▄ÎÞÁ─¼F(xi¿ñn)¤¾ú¼ãõÙè╗»îWðÈ─▄¢Ë¢³Ë┌┘F¢î┘íú¢î┘Á─▀@ÀN╩º╚Ñ┴╦È¡üÝÁ─╗»îW╗¯ðÈÁ─¼F(xi¿ñn)¤¾▒╗ÀQ×ÚÔg╗»ú¼¢î┘Ôg╗»║¾╦¨½@Á├Á──═╬gðÈ┘|(zh¿¼)ÀQ×ÚÔgðÈíúÔg╗»┤¾┤¾¢ÁÁ═┴╦¢î┘Á─©»╬g╦┘Â╚ú¼È÷╝Ë┴╦¢î┘Á──═╬gðÈíú
¢î┘Á─Ôg╗»¼F(xi¿ñn)¤¾ÈþÈ┌20╩└╝o│§¥═▒╗╚╦éâ░l(f¿í)¼F(xi¿ñn)íú└²╚þú¼ÞFÈ┌¤í¤§╦ßÍð©»╬g║▄┐ýú¼Â°È┌ØÔ¤§╦ßÍðät©»╬g║▄┬²íú1836─Ûú¼╦╣┐┬▒╚ÀQ¢î┘È┌ØÔ¤§╦ßÍð½@Á├Á──═╬gá¯æB(t¿ñi)×ÚÔgæB(t¿ñi)íúÁ¢─┐Ã░×ÚÍ╣╚╦éâî┘Á─Ôg╗»ÊÐ▀Mðð┴╦ÅVÀ║Á─Ðð¥┐ú¼▓óÈ┌┐ÏÍã¢î┘©»╬g║═╠ß©▀¢î┘▓─┴¤Á──═╬gðÈÀ¢├µ░l(f¿í)ô]┴╦╩«ÀÍÍÏʬÁ─θË├íú
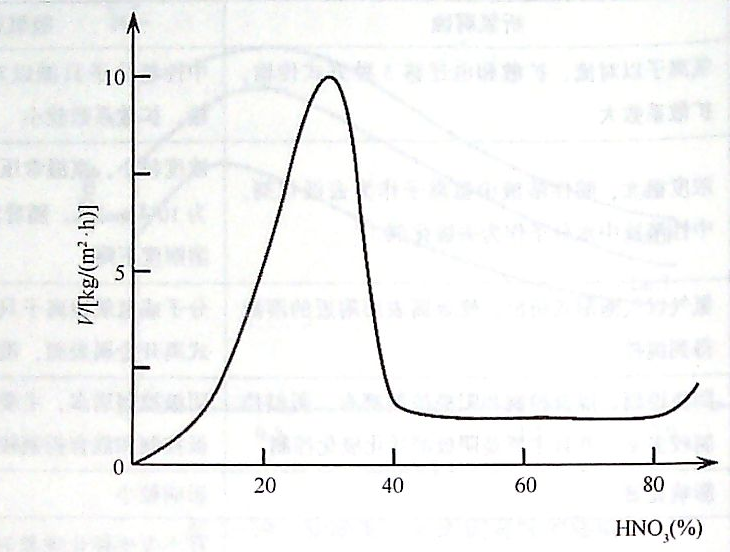
êDú¿1ú®ÞFÈ┌¤§╦ßÍðÁ─╚▄¢Ô╦┘┬╩┼c¤§╦ßÁ─ØÔÂ╚ÛP(gu¿ín)¤Á
1)╗»îWÔg╗»
îóÞFã¼À┼╚╦¤§╦ßÍðú¼Ë^▓ýÞFã¼╚▄¢Ô╦┘┬╩ú¿©»╬g╦┘Â╚ú®┼c¤§╦ßØÔÂ╚Á─ÛP(gu¿ín)¤Áú¼Á├Á¢╚þêD2-21╦¨╩¥Á─Îâ╗»Ã·¥ÇíúÅ─êDÍð┐╔ÊÈ┐┤│÷ú¼«ö¤§╦ßØÔÂ╚¦^Á═òrú¼ÞFÁ─╚▄¢Ô╦┘┬╩ÙSÍ°¤§╦ßÁ─ØÔÂ╚È÷╝Ë°Щ╦┘È÷┤¾íú«ö¤§╦ßØÔÂ╚È÷╝ËÁ¢×Ú30%í¬40%òrú¼ÞFÁ─©»╬g╦┘Â╚▀_Á¢Î¯┤¾ÍÁíú¤§╦ßØÔÂ╚│¼▀^40a/oòrú¼ÞFÁ─╚▄¢Ô╦┘┬╩Щ╦┘¢ÁÁ═ú¼Í▒Á¢À┤æ¬(y¿®ng)¢Ë¢³═úÍ╣ú¼▀@Ê╗«É│ú¼F(xi¿ñn)¤¾╝┤×ÚÔg╗»íú╚þ╣¹└^└m(x¿┤)È÷╝ˤ§╦ßØÔÂ╚ú¼╩╣┘|(zh¿¼)┴┐ÀÍöÁ(sh¿┤)│¼▀^90qoòrú¼©»╬g╦┘Â╚ËÍËð¦^┐ýÁ─╔¤╔²ú¼▀@Ê╗¼F(xi¿ñn)¤¾ÀQ×Ú▀^Ôg╗»íú¢ø(j¿®ng)▀^ØÔ¤§╦ß╠Ä└ÝÁ─ÞFÈ┘À┼╚╦¤í¤§╦ß╗‗┴‗╦ßÍðÊ▓─▄▒ú│ÍÊ╗¿Á─òrÚg▓╗ò■╩▄Á¢©»╬gú¼ãõÈ¡Ê‗╩âî┘▒Ý├µÊТø(j¿®ng)░l(f¿í)╔·┴╦Ôg╗»íú
│²ÞFÍ«═Ôú¼ãõ╦¹¢î┘╚þÒtíóµçíóÒ@íóÒ~íóÒgíóÔëíóµuíóÔüÁ╚ú¼È┌▀m«öùl╝■¤┬Ê▓ò■«a(ch¿ún)╔·Ôg╗»íú─▄╩╣¢î┘Ôg╗»Á─╬´┘|(zh¿¼)¢y(t¿»ng)ÀQ×ÚÔg╗»ä®ú¼╚þØÔ¤§╦ßíóKú¼Cri0ú¼íóKMn0íúíóKC10íúÁ╚ÅèЧ╗»ä®ÊÈ╝░╚▄Ê║Íð╗‗┤¾ÜÔÍðÁ─Чíú─│ð®ÀÃЧ╗»ðÈÈçä®Ê▓─▄╩╣─│ð®¢î┘Ôg╗»ú¼└²╚þµV┐╔È┌ÜõÀ·╦ßÍðÔg╗»ú¼Òf║═Ôë┐╔È┌¹}╦ßÍðÔg╗»ú¼╣»║═ÒyÈ┌CI-Á─θË├¤┬Ùè─▄░l(f¿í)╔·Ôg╗»íú

êDú¿2ú®┴‗╦ß╣Ì▓╔Ë├╠╝õô▓─┘|(zh¿¼)Íãθ͸ʬÊ‗×ÚÔg╗»¼F(xi¿ñn)¤¾
ÍÁÁ├ÎóÊÔÁ─╩Ãú¼Ôg╗»Á─░l(f¿í)╔·▓ó▓╗║åå╬ÁÏ╚íøQË┌Ôg╗»ä®Ð§╗»─▄┴ªÁ─Åè╚§íú└²╚þú¼Hú║0ú║║═KMn0íú╚▄Ê║Á─Ч╗»▀ÇÈ¡Ùè╬╗▒╚Kú¼Cr.0ú¼╚▄Ê║©▀ú¼╩é³ÅèÁ─Ч╗»ä®ú¼Á½îìÙH╔¤╦³éâîªÞFÁ─Ôg╗»Î¸Ë├às▒╚║¾ı▀©³╚§ú╗Naú║Sú║0íúЧ╗»▀ÇÈ¡Ùè╬╗©³©▀ú¼┐╔╩Ã╦³À┤°▓╗─▄╩╣ÞFÔg╗»íú´@╚╗ú¼▀@┼cÛÄÙxÎËÁ─╠ÏðÈ╝░Ùè╬╗îªÔg╗»▀^│╠Á─Ë░n¤‗ËðÛP(gu¿ín)íú
¥C╔¤╦¨╩÷ú¼¢î┘┼cÔg╗»ä®Á─╗»îWθË├°«a(ch¿ún)╔·Á─Ôg╗»¼F(xi¿ñn)¤¾ÀQ×Ú╗»îWÔg╗»╗‗ÎÈÔg╗»íú└²╚þú¼ÒtíóõXíóÔüÁ╚¢î┘È┌┐ıÜÔÍð║═║▄ÂÓÀN║¼Ð§Á─╚▄Ê║ÍðÂ╝ÊÎ▒╗ЧÔg╗»ú¼╣╩ÀQ×ÚÎÈÔg╗»¢î┘íú
¢î┘Îâ?y¿¡u)ÚÔgæB(t¿ñi)òrú¼ãõÙèÿOÙè╬╗Ê╗░Ò│»ı²Á─À¢¤‗ÊãäËíú└²╚þú¼F(xi¿ñn)eÁ─Ùè╬╗×Ú-0.2-0.2Vú«Ôg╗»║¾╔²©▀Á¢0.5í¬1ú«ovú╗CrÁ─Ùè╬╗×Ú-0.6í½0.4 V,Ôg╗»║¾×Ú0.8~l-0 VíúË╔Ë┌Ùè╬╗╔²©▀ú¼Ôg╗»║¾Á─¢î┘╩º╚ÑÈ¡ËðÁ──│ð®╠ÏðÈú¼└²╚þÔg╗»║¾Á─ÞFÈ┌Ò~¹}Íð▓╗─▄îóÒ~Í├ôQ│÷üÝíú
- ╔¤Ê╗ã¬ú║ë║┴ª20MPa£ÏÂ╚160íµØÔÂ╚20%HCl¹}╦ߢ■┼¦4hÈç‗×¢Y(ji¿ª) 2019/4/22
- ¤┬Ê╗ã¬ú║ÜõÀ·╦ßÀ└©»╬gË├KN17À└©»─═─Ñ═┐┴¤ðº╣¹´@Í° 2016/9/5
